
Il pensiero del noto medico asclepiade è riassunto in una sua frase «Le cose sacre non devono essere insegnate che alle persone pure; è un sacrilegio comunicarle ai profani prima di averli iniziati ai misteri della scienza» (Prolegomeni – Ippocrate 460-377 A.C.). Diventa invece necessario nel terzo millennio uscire da silenzi o assiomi o modi di dire vecchi 2400 anni alla luce dei nuovi riscontri scientifici e dare una spinta anche clinica a tutto ciò che negli ultimi vent’anni è stato osservato dalla ricerca scientifica (in tutti gli ambiti dall’immunologia all’oncologia alla neurologia e ovviamente alla gastroenterologia) e quindi implementando gli approcci diagnostici e quelli terapeutici. Salute e benessere sono correlati di certo a ciò che mangiamo, ma ciò che ci nutre viene “introdotto” nei nostri sistemi funzionali grazie al microbiota e alla personale attività genomica di ciascuno di noi.
Il patrimonio genetico ci rappresenta a uno a uno ed è grazie a esso che ci rapportiamo con l’ambiente e anche con il cibo, ma in quanto “esseri eterotrofi” lo stesso patrimonio genetico non è sufficiente a farci vivere (l’eterotrofia è la condizione nutrizionale di un organismo vivente che non è in grado di sintetizzare tutte le proprie molecole organiche autonomamente a partire da altre molecole inorganiche).
Il microbiota è necessario e funzionale alla nostra sopravvivenza: è la comunità di microrganismi che in simbiosi con l’individuo vive con reciprocità vitale. Il microbiota intestinale è l’insieme di quei microrganismi che risiede nel tratto gastrointestinale: i batteri rappresentano le comunità più abbondanti, altre comunità di minore entità sono costituite da funghi (il micobiota), archea, virus. Il termine microbioma invece indica la totalità del patrimonio genetico posseduto dal microbiota: il genoma, il trascrittoma, il proteoma.
Dal giorno della nascita un bambino subirà immancabilmente per un periodo di tempo il “calo ponderale fisiologico” (perdita di peso) conseguente alla sua sterilità, all’assenza di microrganismi che lo possano aiutare a crescere, a vivere. Durante le prime quarantotto h di vita e in funzione della modalità di nascita (parto naturale o cesareo) si svilupperanno e riscontreranno fino a un milione di unità formanti colonia (UFC batteriche) per grammo di materiale fecale e nella settimana successiva l’incremento supererà il miliardo per UFC variando anche le tipologie di specie generi e phyla (i macro gruppi batterici) che a mano a mano avranno la loro evoluzione qualitativa e quantitativa fino allo svezzamento e successivamente durante la vita di ciascun individuo. Dalla bocca in giù un crescendo di specie batteriche necessarie e funzionali alla crescita e in particolare allo sviluppo e al potenziamento del sistema immunitario che riconoscerà amici e nemici nell’ambiente e soprattutto dentro il corpo e in particolare il riconoscimento del sé, meccanismo fondamentale affinché non aggredisca le nostre stesse cellule (autoimmunità).
Il genobioma è l’insieme interagente di un sistema genetico complesso, ovvero tutto il patrimonio genetico degli organismi unicellulari e\o pluricellulari conviventi in un unico sistema, ovvero in simbiosi. Noi siamo il nostro genobioma e in funzione di ciò possiamo essere ciò che mangiamo e quindi cambiare anche ciò che siamo. La definizione che più si avvicina oggi al nostro rapporto con il non banale atto di “mangiare” è:
“siamo il nostro genobioma e grazie a esso siamo anche ciò che mangiamo”
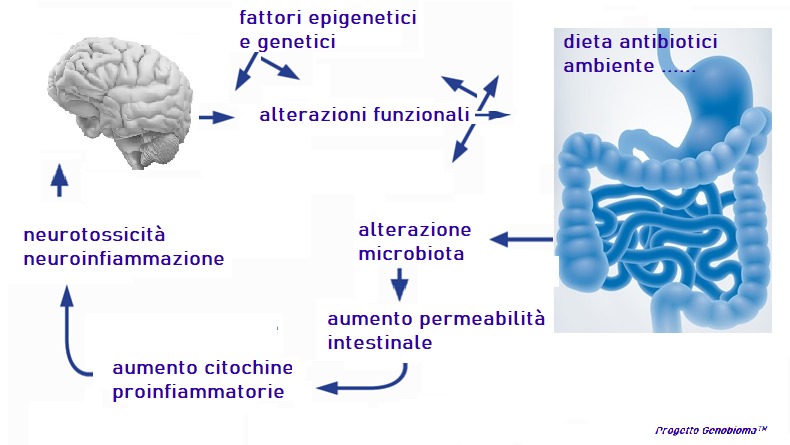
Oltre un milione di miliari sono i batteri che convivono nel nostro corpo, il loro patrimonio genetico è 150 volte superiore al nostro (oltre tre milioni di geni rispetto ai nostri circa 20 mila), il genobioma è per circa il 90% l’insieme dei microrganismi simbionti e solo il 10 % “siamo noi”. Sono almeno 9 i Phyla batterici (sugli oltre 30 in natura) presenti in ciascuno di noi: Bacteriodetes e Firmicutes sono quelli maggiormente rappresentati (oltre l’80% del totale) insieme ad Actinobacteria, Proteobacteria, Fusobacteria, Cyanobacteria e altri, che si distribuiscono in particolare lungo il tratto gastrointestinale in un crescendo quali-quantitativo e variabile in funzione delle variabili genetiche ed epigenetiche (ambiente dieta stress farmaci antibiotici nutraceutici acqua età patrimonio genetico clima ritmi temporali da circadiani ad annuali posizione geografica). L’espressione di un gene dell’intero genobioma è modificata o modificabile a causa di azioni esterne al genoma stesso e che può quindi cambiare la funzionalità di un tessuto o di un organo o di un sistema fisiologico o dello stesso microbiota anche in modo permanente e ormai è noto anche ereditabile, ovvero trasmissibile alla generazione successiva.
La biodiversità del microbiota è fondamentale affinché le relazioni funzionali tra le diverse specie non siano compromesse tra loro: include gli aspetti tassonomici, funzionali e temporali della diversità negli organismi viventi, i parametri di misura più importanti sono la “richness” (il numero di specie, almeno 1000 specie diverse quelle del microbiota intestinale) e la “evenness” (abbondanza relativa di specie, la quantità di una singola specie che da sola può condizionare anche una sola funzionalità fisiologica dell’ospite).
I batteri comunicano tra di loro utilizzando un linguaggio “comune” costituito da “vettori chimici/biochimici” che consentono quindi epigeneticamente di far esprimere o meno un gene e quindi di costruire una proteina utile o meno all’ambiente in cui vivono o a se stessi e “contandosi” (quorum sensing) stabiliscono anche se e quando trascrivere una determina proteina. Il quorum sensing tra batteri permette comunicazioni tra specie e phyla ed anche regni diversi e questo rende ancora più complesso lo studio simultaneo del genoma microbico (metagenomica). Il premio Nobel Joshua Lederberg coniò il termine “superorganism” ovvero l’insieme di cellule umane e non umane che occupano lo spazio del nostro corpo fisico, insomma quasi l’odierno genobioma: «La velocità dell’evoluzione dei microbi non ha paragoni con quella dei mammiferi, essendo anche un miliardo di volte maggiore. Un anno nella vita dei batteri è pari all’intera durata dell’evoluzione dei mammiferi (J. Lederberg, 2009).
Ma cosa fa il microbiota? Una semplice elencazione dà l’idea di quanto sia complesso anche solo descriverne l’incredibile funzionalità e importanza vitale per un essere umano:
Funzioni metaboliche: produzione di cofattori e vitamine, biosintesi di aminoacidi, fermentazione substrati non digeribili, biotrasformazione degli acidi biliari, assorbimento di acqua e sali minerali, fonte di energia, produzione di acidi grassi a catena corta (SCFA: short chain fatty acids), rilascio di antimicrobici e antimicotici.
Funzioni protettive: resistenza alla colonizzazione di altre specie batteriche (patogeni), attivazione e regolazione immunità innata e adattativa e regolazione delle citochine infiammatorie.
Funzioni strutturali: accrescimento e differenziazione dell’individuo ospite, regolazione della corretta funzionalità degli enterociti e delle cellule epiteliali, sviluppo dei villi e delle cripte intestinali, funzionalità della permeabilità intestinale, produzione di muco e fortificazione della barriera protettiva intestinale.
Approfondiremo in itinere e un po’ alla volta i rapporti tra il nostro microbiota intestinale e il sistema immunitario, le relazioni che esistono e che sono state dimostrate negli ultimi anni rispetto alla sua variazione e al suo peggioramento implicato in azioni neurotossiche, epatotossiche, immunotossiche e molto più.
Scopriremo insieme quanto oggi è noto alla ricerca scientifica rispetto a disagi patologie e sindromi come il Parkinson l’autismo piuttosto che la colite retto-ulcerosa, il cancro colon-rettale o malattie autoimmuni come celiachia il crohn la psoriasi o l’artrite reumatoide e così via fino alla protezione da aggressioni esterne come quelle virali (oggi è noto anche l’impatto tra microbiota intestinale e SARS-CoV-2 e la correlata malattia se e quando eventualmente presente Covid-19) e un lungo elenco di patologie oggi “trattate” sintomaticamente e delle quali è nota la relazione etiopatologica con il microbiota intestinale, e non solo intestinale. Analizzeremo e indagheremo a fondo le ricerche delle riviste scientifiche e le scoperte degli ultimi 5 anni per meglio comprendere quanto siano efficaci (o meno) co-terapie nutrizionali o nutraceutiche o nutrigenomiche associate a un preciso rationale terapeutico per il miglioramento funzionale del microbiota e quindi della patologia sofferta.
Dott Daniele Tedeschi – Dott.ssa Marika Iabichella Progetto Genobioma ™
Se avete domande, il Dottor Daniele Tedeschi e la Dott.ssa Marika Iabichella saranno lieti di rispondervi. Buona vita!



